为进一步落实《粤港澳大湾区发展规划纲要》,去年9月,国家市场监管总局、国家美国食品药品监督管理局等八部委发布了《粤港澳大湾区药品医疗器械监管创新发展工作方案》。广东省药品监督管理局牵头,会同省卫生健康委、海关总署广东分署等相关部门和深圳市,在香港大学深圳医院组织开展了“港澳医疗设备通信”试点,取得了良好的效果,具备条件的可推广到符合要求的其他城市和粤港澳大湾区定点医疗机构。
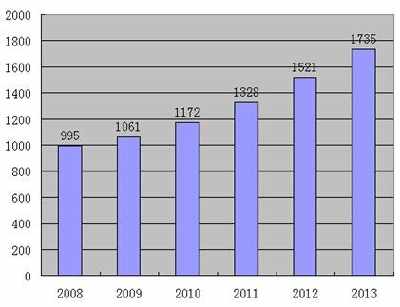
“自今年1月‘港澳医疗器械准入’政策试点以来,临床急需的9种进口药品和2种医疗器械获批,累计惠及150名患者。其中,世界上有许多新型抗癌药物,如恩替卡韦和劳罗替尼。”广东省药品监督管理局党组成员苏胜峰介绍。
据悉,为在粤港澳大湾区内地9个城市正式推广实施“港澳医疗器械通”政策,广东省药品监督管理局牵头组织制定发布了《广东省粤港澳大湾区内地急需进口港澳药品医疗器械管理暂行规定》等政策配套制度文件。这些配套政策将为医疗机构、配送企业等参与者提供明确的指引,为政策在大湾区内地9个城市的推广实施提供制度保障。记者了解到,目前已审核认定内地首批定点医疗机构5家,涉及广州2家、深圳1家、珠海1家、中山1家。
同时,《关于简化在港澳已上市传统外用中成药注册审批的公告》也在当天正式发布。此举将有力推动粤港澳大湾区中医药产业的融合发展。
据报道,港澳地区中药生产厂家众多,当地市场有限。实施简化注册审批政策,有助于港澳中医药企业开拓内地市场,推动港澳中医药产业做大做强,实现粤港澳大湾区中医药产业共同发展。此外,政策制定的外用中成药内地注册标准,将推动粤港澳大湾区中医药质量标准合作研究,加快粤港澳中医药标准对接,推动粤港澳大湾区中医药标准化、国际化。